Biossensores
Biossensores
Os biossensores podem ser definidos, como dispositivos constituídos de um elemento de reconhecimento biológico (anticorpos, enzimas, proteínas, ácidos nucléicos, organelas e células), com a propriedade de reconhecer e interagir com o analito de interesse. Essa interação resulta na alteração de propriedades físico-químicas, que são detectadas e medidas pelo transdutor, que converte a informação em um sinal mensurável. A definição é ilustrada na Figura 1.
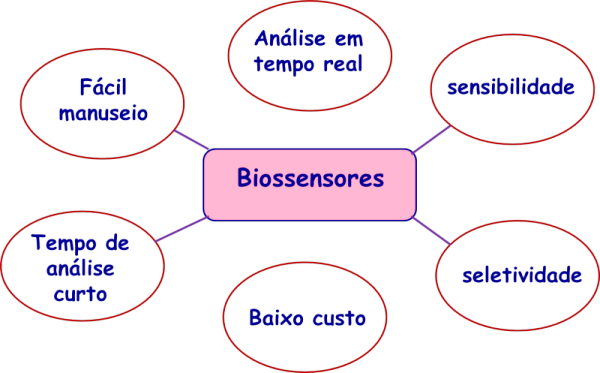
Para garantir uma boa funcionalidade, os sensores, em geral, devem apresentar algumas das características apresentadas na Figura 2:
A utilização dessa tecnologia interdisciplinar oferece oportunidades de monitoramento no campo ambiental, saúde, veterinária, agricultura, pecuária, entre outras.
A maioria das formas de transdução pode ser categorizada em métodos de detecção eletroquímica, termométrica, óptica, etc.
Os sensores eletroquímicos, em que um eletrodo é utilizado como elemento de transdução, destacam-se devido a sua ampla faixa linear de resposta, boa sensibilidade, confiabilidade e reprodutibilidade. Neste contexto, a produção de filmes finos utilizando a técnica camada por camada (do inglês Layer by Layer – LbL) [2] para modificar eletrodos, vem permitindo a fabricação de uma série de novos sistemas/dispositivos, proporcionando vantagens como: baixo custo, fácil manuseio e interações sinérgicas entre os diferentes componentes do filme [3].
Os biossensores ópticos baseados no imunoensaio de fluxo lateral (LFIA), também chamado de ensaio imunocromatográfico, são uma ferramenta atrativa [4-6] e um exemplo de método que vem sendo utilizado na detecção de proteínas, toxinas, entre outros. A aplicação mais conhecida é o teste de gravidez, que foi baseado na detecção de HCG na urina [5, 7]. O LFIA tem recentemente gerado interesse científico e industrial, por permitir diagnósticos in situ, rápidos e de fácil manuseio, em que a análise qualitativa pode ser obtida pela observação dos resultados a olho nu [4, 6].
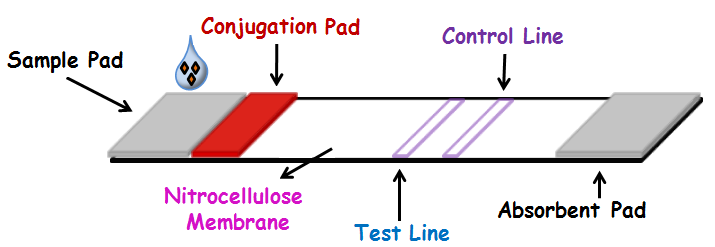
O LFIA consiste geralmente de 4 partes diferentes: o sample pad, o conjugation pad, o detection pad e o absorbent pad (Figura 3). O sample pad, feito de celulose, tem o papel de aceitar a amostra, filtrar a amostra a partir de impurezas e armazenar o tampão de ensaio. O conjugation pad, geralmente feito de fibras de vidro, é utilizado para armazenar os marcadores (como por exemplo, as nanopartículas de ouro (AuNP), quantum dots, etc). Ele aceita o conjugado e o mantém estável, liberando-o quando o ensaio está sendo executado. No detection pad, feito de nitrocelulose, os reagentes de captura são imobilizados e o sinal é desenvolvido. Finalmente, o absorbent pad, que normalmente consiste de celulose, tem o papel de retirar todo o líquido adicionado na tira, mantendo-o na região do absorbent pad durante o ensaio [5, 8].
[1] Pejcic, B.; De Marco, R.; Parkinson, G. The role of biosensors in the detection of emerging infectious diseases. Analyst, v. 131, p. 1079-1090. 2006.
[2] Decher, G. Fuzzy. Nanoassemblies: toward layered polymeric multicomposites. Science, v. 277, p. 1232–1237. 1997.
[3] Crespilho, F. N.; Zucolotto, V.; Oliveira Jr.; O. N.; Nart, F. C. Electrochemistry of Layer-by-Layer Films: a review. Int. J. Electrochem. Sci., v. 1, p. 194-214. 2006.
[4] Nagatani, N.; Tanaka, R.; Yuhi, T.; Endo, T.; Kerman, K.; Takamura, Y.; Tamiya, E.; Gold nanoparticle-based novel enhancement method for the development of highly sensitive immunochromatographic test strips. Sci. Technol. Adv. Mater., v.7, p. 270-275. 2006.
[5] Wong, R. C.; Tse, H. Y. Lateral Flow Immunoassay. Springer, DOI 10.1007/978-1-59745-240-3, 224 pg. 2009.
[6] Anfossi, L.; Baggiani, C.; Giovannoli, C.; D’Arco,G.; Giraudi, G. Lateral-flow immunoassays for mycotoxins and phycotoxins: a review. Anal. Bioanal. Chem., v. 405, p. 467-480. 2013.
[7] De la Escosura-Muñiz, A.; Parolo, C.; Merkoçi, A. Immunosensing using nanoparticles. Materials Today, v. 13, p. 24–34. 2010.
[8] Parolo, C.; Merkoci, A. Paper-based nanobiosensors for diagnostics. Chem. Soc. Rev., v. 42, p. 450-457. 2013.